Lo que debes saber:
– el Administración de Alimentos y Medicamentos de EE. UU. (FDA) Recientemente ha emitido varias aprobaciones importantes, lo que representa avances importantes en diagnóstico, cirugía y monitorización remota de pacientes.
-Estas autorizaciones de la FDA reflejan una profunda integración Inteligencia artificial (IA) y tecnología avanzada en los flujos de trabajo clínicos, que promete mayor precisión, menos invasividad y mayor acceso a la atención.
Diagnóstico y monitorización remotos: inteligencia artificial y dispositivos portátiles a escala
Una tendencia importante en las aprobaciones recientes se centra en aprovechar la inteligencia artificial y los dispositivos portátiles ergonómicos para mejorar la velocidad del diagnóstico y la continuidad de la atención.
Monitorización cardíaca y pulmonar portátil
Hexoskin recibe autorización 510(k) para electrocardiogramas y monitorización respiratoria a largo plazo
Carré Technologies Inc. (dba Hexoskin). Autorización 510(k) para el Hexoskin Medical System (HMS) para ECG continuo a largo plazo y monitorización respiratoria y de actividad en pacientes ambulatorios. Este sistema, que incluye una camiseta biométrica inteligente, se convierte en uno de los primeros sistemas médicos portátiles capaces de realizar ECG y mediciones respiratorias a largo plazo fuera de la clínica, transformando la teleasistencia y los ensayos clínicos descentralizados. Esta tecnología permite a los médicos evaluar los latidos cardíacos irregulares (como la fibrilación auricular) y los patrones de frecuencia respiratoria mediante la recopilación de datos continuamente.
Para la investigación clínica, HMS representa un gran paso adelante. Con la aprobación de la FDA, el sistema ahora puede respaldar ensayos descentralizados, lo que permite a los investigadores capturar datos fisiológicos del mundo real de alta resolución y desarrollar biomarcadores digitales impulsados por inteligencia artificial en cardiología, enfermedades pulmonares, neurología y enfermedades raras.
Imágenes cardíacas y aórticas basadas en inteligencia artificial
Las autorizaciones de la FDA consolidan el papel de la IA en la gestión del riesgo cardiovascular:
RapidAI recibe la aprobación de la FDA para Rapid Aortic, que proporciona IA clínica profunda para el tratamiento de enfermedades aórticas
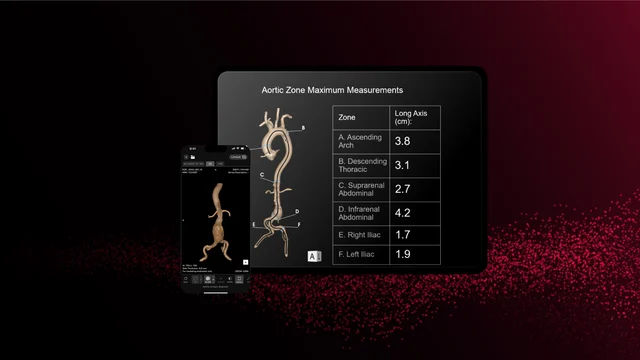
RapidAI Está aprobado por la Administración de Medicamentos y Alimentos de EE. UU. (FDA) para administración aórtica, que forma parte del producto Rapid Aortic. Esta profunda solución de IA clínica está transformando la evaluación aguda y el tratamiento longitudinal de la enfermedad aórtica. Genera automáticamente mediciones de interés (incluidos máximos zonales y métricas de puntos de referencia), produce reconstrucciones 3D y realiza un seguimiento de los cambios anatómicos a lo largo del tiempo para ayudar a identificar y rastrear la patología desde el arco aórtico hasta el ilion.
A diferencia de las herramientas tradicionales de clasificación basadas en IA, Rapid Aortic está diseñado para respaldar la gestión integral del paciente: detección, diagnóstico, planificación del tratamiento y seguimiento. La capacidad del sistema para procesar todas las tomografías computarizadas que involucran la aorta (tanto con contraste como sin contraste) amplía su utilidad en entornos de emergencia, hospitalizados y ambulatorios.
Los médicos se benefician de una carga cognitiva reducida, tiempos de lectura más rápidos y una precisión mejorada. Los cirujanos pueden aprovechar visualizaciones precisas para planificar previamente los procedimientos, mientras que los sistemas de salud obtienen flujos de trabajo unificados integrados con Rapid Edge Cloud y Rapid Navigator Pro.
Circle CVI ha recibido autorización 510(k) para análisis de placa coronaria impulsado por IA
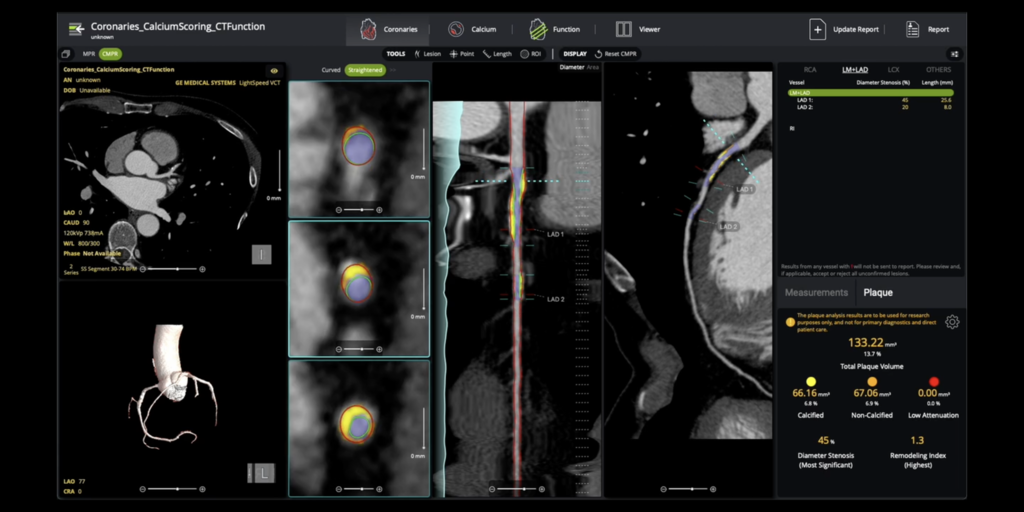
Círculo CVI Obtuve una autorización 510(k) para cvi42| Solución de placa para el análisis integral de la placa coronaria. Esta tecnología local impulsada por IA cuantifica la placa total, calcificada y no calcificada, lo que respalda una estratificación precisa del riesgo. Esta aprobación coincide con el nuevo código CPT Clase I (75XX6) que entrará en vigor en enero de 2026, promoviendo la cuantificación de placa como atención clínica estándar.
Bunkerhill Health recibe la autorización de la FDA para la primera IA que detecta la calcificación del anillo mitral a partir de una TC de tórax de rutina

Salud de Bunkerhill Recibió la primera aprobación de la Administración de Medicamentos y Alimentos de EE. UU. (FDA) para un algoritmo de inteligencia artificial, Bunkerhill MAC, para detectar y medir la calcificación del anillo mitral (MAC) mediante tomografías computarizadas de tórax de rutina y no sincronizadas. MAC es un hallazgo que a menudo se pasa por alto y se asocia con un mayor riesgo cardiovascular y complicaciones del procedimiento.
Esta herramienta, integrada en la plataforma Carebricks de Bunkerhill, aprovecha la inteligencia artificial aprobada por la FDA y el razonamiento basado en modelos de lenguaje amplio para respaldar las decisiones de seguimiento dentro de los programas de cardiología, atención primaria y corazón estructural. Esta autorización refleja la confianza más amplia de la FDA en la inteligencia artificial que convierte los hallazgos incidentales en conocimientos clínicos procesables.
Neurociencia y manejo del dolor.
Muchos procedimientos de filtrado tienen como objetivo la función cerebral y el dolor crónico:
QuantalX recibió la autorización de De Novo para Delphi-MD, una tecnología de neuroimagen funcional primera en su tipo
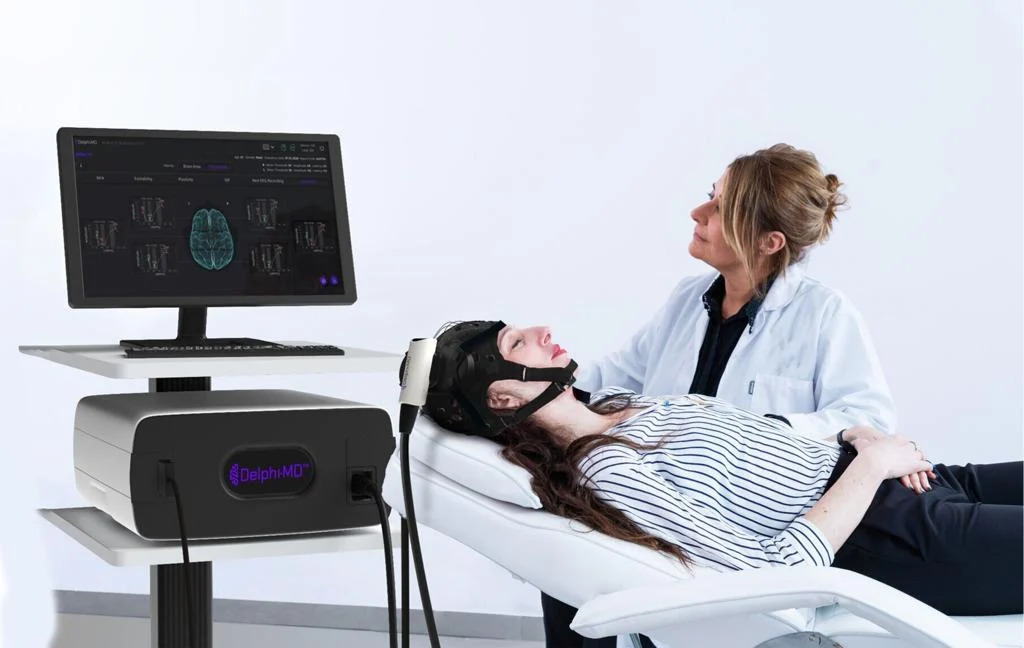
Neurociencia Quantalix Recibió la designación De Novo por su sistema Delphi-MD™, creando un nuevo método de neuroimagen funcional (FNI). Delphi-MD combina estimulación magnética transcraneal (TMS) no invasiva con electroencefalografía (EEG) para medir la función de la red cerebral en comparación con una base de datos estándar.
Delphi-MD proporciona a los médicos una evaluación comparativa de la función cerebral utilizando una base de datos estandarizada aprobada por la FDA para adultos sanos. Esto crea un nuevo método clínico capaz de monitorear el deterioro cognitivo, evaluar intervenciones neurológicas y ayudar en el manejo de enfermedades neurodegenerativas, traumáticas o relacionadas con el dolor.
Magstim ha sido aprobado por la Administración de Medicamentos y Alimentos de EE. UU. (FDA) para estimulación magnética no invasiva para el tratamiento del dolor crónico.
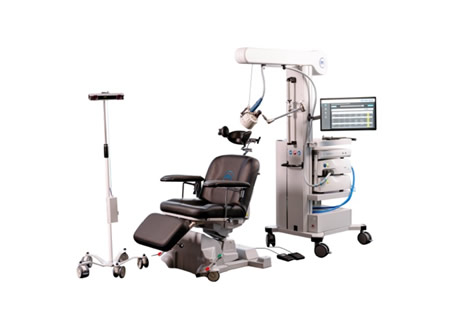
Aprobado por la FDA Estimulación Magnética Maestra Para tratar el dolor crónico, brindando una opción clínicamente probada, no quirúrgica y sin medicamentos. Esta tecnología modula las vías de los nervios periféricos mediante pulsos magnéticos, llegando a nervios más profundos sin necesidad de implantes invasivos ni productos farmacéuticos.
La tecnología de Magstim, citada en más de 15.000 estudios científicos, proporciona una estimulación nerviosa más profunda en comparación con los TENS tradicionales o los dispositivos de nivel de superficie, proporcionando una opción importante para los pacientes para quienes los tratamientos convencionales son inadecuados.
Robótica quirúrgica y microortopedia.
Las innovaciones en el campo de la asistencia robótica tienen como objetivo mejorar la precisión y reducir los impactos:
Zimmer Biomet recibe autorización 510(k) para ROSA Knee a través de OptimiZe, ampliando la precisión robótica en cirugía ortopédica
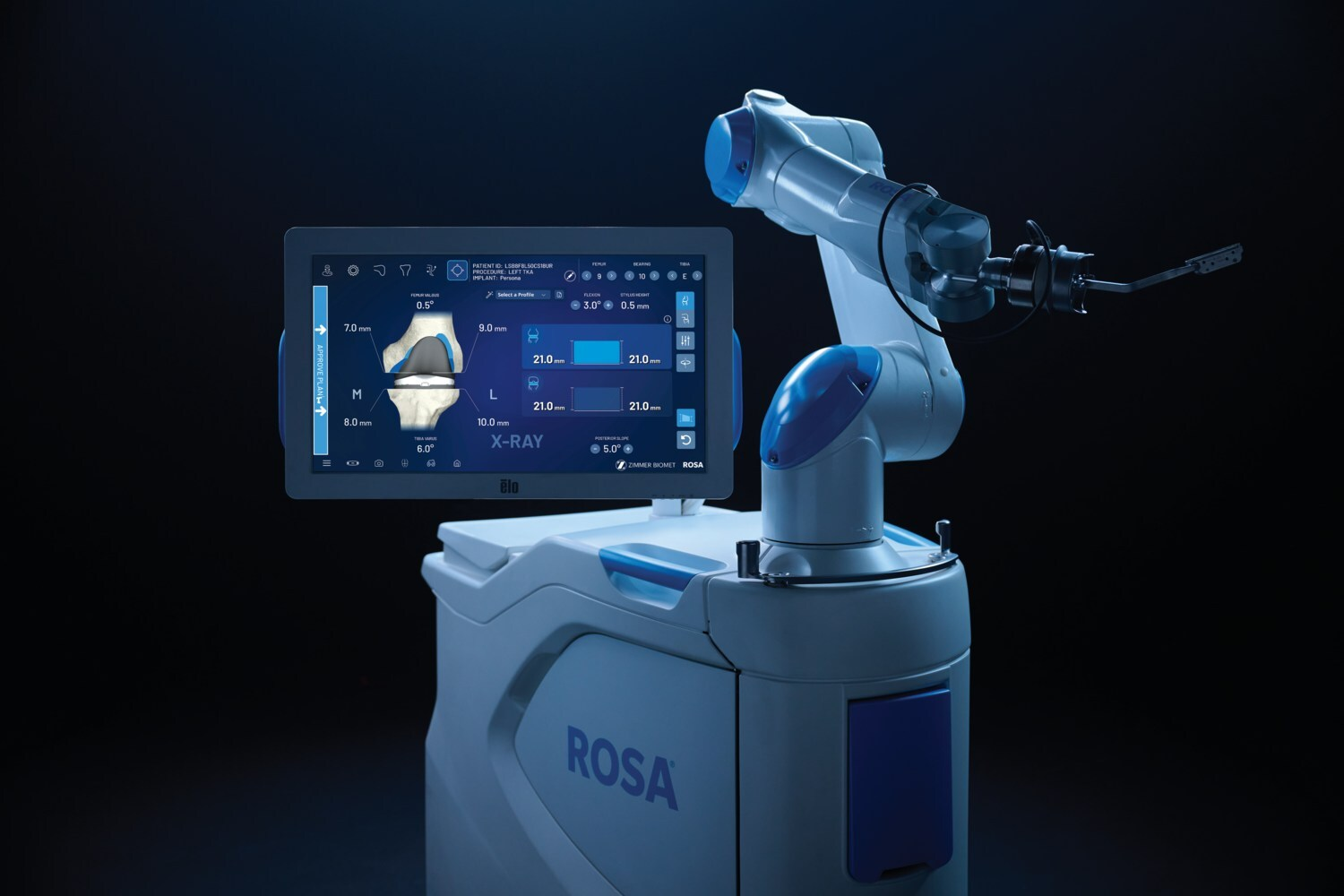
Zimmer Biomet Ha obtenido una licencia 510(k) para ROSA® Knee con OptimiZe™, una versión mejorada de su sistema robótico para cirugía de reemplazo total de rodilla. Esta tecnología proporciona planificación quirúrgica inteligente y personalizada y funciones como OptimiZe Kinematic Alignment™, la única función de alineación cinemática automatizada de la industria, para garantizar resultados precisos y reproducibles basados en la anatomía del paciente y las preferencias del cirujano.
Integrado con ZBEdge® Analytics, ROSA Knee con OptimiZe permite decisiones basadas en datos, información sobre el proceso en tiempo real y evaluación continua del desempeño. El lanzamiento previsto comenzará a finales de este año y se espera que esté disponible comercialmente en EE. UU. a principios de 2026.
Levita Magnets recibe autorización pediátrica para el sistema quirúrgico magnético (MSS)
Imanes Levita® Ha recibido la aprobación de la Administración de Alimentos y Medicamentos de EE. UU. (FDA) para su sistema quirúrgico magnético (MSS) para pacientes pediátricos. Esta tecnología utiliza un imán externo para controlar los instrumentos quirúrgicos internos, lo que reduce la cantidad de incisiones necesarias para procedimientos como la colecistectomía laparoscópica, que es fundamental para reducir el trauma y las cicatrices en los niños.
El Cleveland Clinic Children’s Hospital se convirtió en el primer centro en realizar un caso pediátrico utilizando esta tecnología. Para los pacientes más jóvenes, minimizar el trauma tisular es crucial: menos puertos pueden conducir a una recuperación más rápida, menos dolor, menos cicatrices y un menor riesgo de complicaciones.
La Administración de Alimentos y Medicamentos de EE.UU. (FDA) ha aprobado el primer estudio quirúrgico robótico para la intervención en la enfermedad de Alzheimer

MMI (Microinstrumentos médicos, Inc.) Recibió la aprobación de la Administración de Medicamentos y Alimentos de EE. UU. (FDA) para una exención de dispositivo en investigación (IDE) para un estudio clínico (REMIND) que utiliza el sistema quirúrgico Symani® para una nueva intervención microquirúrgica para la enfermedad de Alzheimer. El estudio tiene como objetivo restablecer las vías de drenaje linfático en los ganglios linfáticos cervicales profundos para mejorar la eliminación de proteínas dañinas. Este procedimiento requiere extrema precisión microquirúrgica y se realiza en vasos tan pequeños como 0,2 mm.
Cuidado de heridas y manejo de la diabetes.
Rapid Nexus recibe autorización 510(k) para Hemastyl, un gran avance en el tratamiento de heridas crónicas
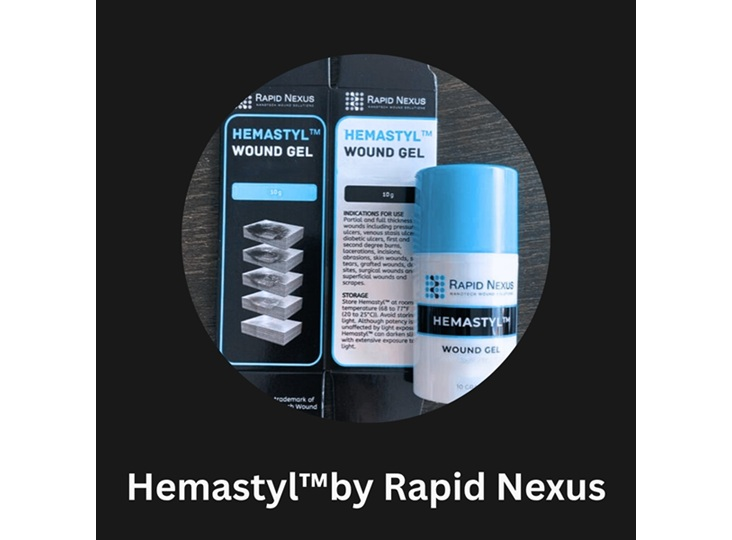
Rapid Nexus Nanotech Wound Solutions, Inc. Ha recibido la aprobación 510(k) de la FDA para su dispositivo de gel Hemastyl. El gel es el primer dispositivo que manipula directamente el entorno del tejido que rodea una herida (el borde vivo responsable de detener la curación) para restaurar las condiciones necesarias para el cierre de la herida y ayudar a los pacientes a evitar amputaciones.
Rapid Nexus planea buscar la designación de un dispositivo innovador por parte de la FDA, lo que podría acelerar la cobertura y las vías de reembolso, haciendo que este tratamiento esté disponible para millones de pacientes de alto riesgo en todo el país. El proceso de descontaminación es un momento histórico en el proceso de curación de heridas, un campo dominado durante mucho tiempo por enfoques para tratar los síntomas más que la etiología.
Tandem Diabetes Care ha recibido la aprobación de la Administración de Medicamentos y Alimentos de EE. UU. (FDA) para su aplicación Tandem Mobi para usuarios de Android
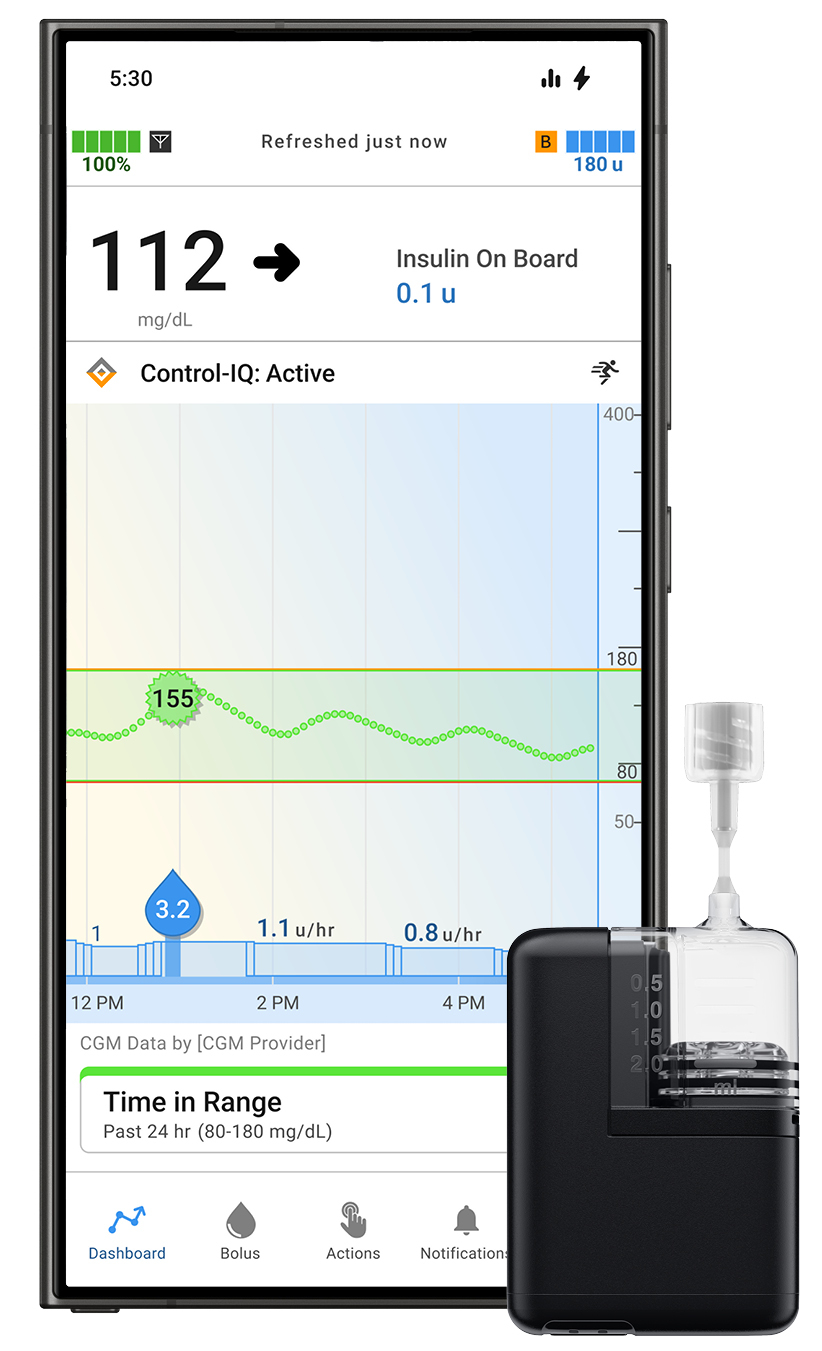
Cuidado de la diabetes en tándem, Inc. Obtuvo la aprobación de la FDA para la versión Android de la aplicación móvil Tandem Mobi. Esto permite a los usuarios de Android controlar la diabetes directamente desde su teléfono inteligente compatible utilizando el sistema automatizado de administración de insulina Tandem Mobi, impulsado por la tecnología Control-IQ+.
Esta aprobación amplía significativamente el acceso para los pacientes que prefieren dispositivos Android, mejorando la facilidad de uso y la adherencia del paciente. Se espera un lanzamiento limitado para finales de 2025, con una disponibilidad comercial generalizada a principios de 2026.












